截至2022年12月28日,全球已有6.5亿人感染新冠病毒,逾665万人死亡。近期,中国政府改变了对新冠病毒感染的防控措施后,各地先后出现“第一波”感染高峰,大量感染患者及重症患者的出现,对中国医疗资源产生了巨大的压力。为规范和指导新冠病毒感染诊治,国家卫健委近期出台了《新型冠状病毒感染诊疗方案(试行第十版)》,但是,迄今为止,对于重症患者的救治方案依然存在持续优化的需求。
近期的研究发现,新冠重症的发病机制之一是STAT-3(信号传导及转录激活蛋白-3)信号通路的激活[1]。在未感染时,STAT-1占优势,感染新冠病毒后,其NSP1和ORF6蛋白启动,会引起STAT1功能障碍以及STAT3的代偿性激活。如下图:
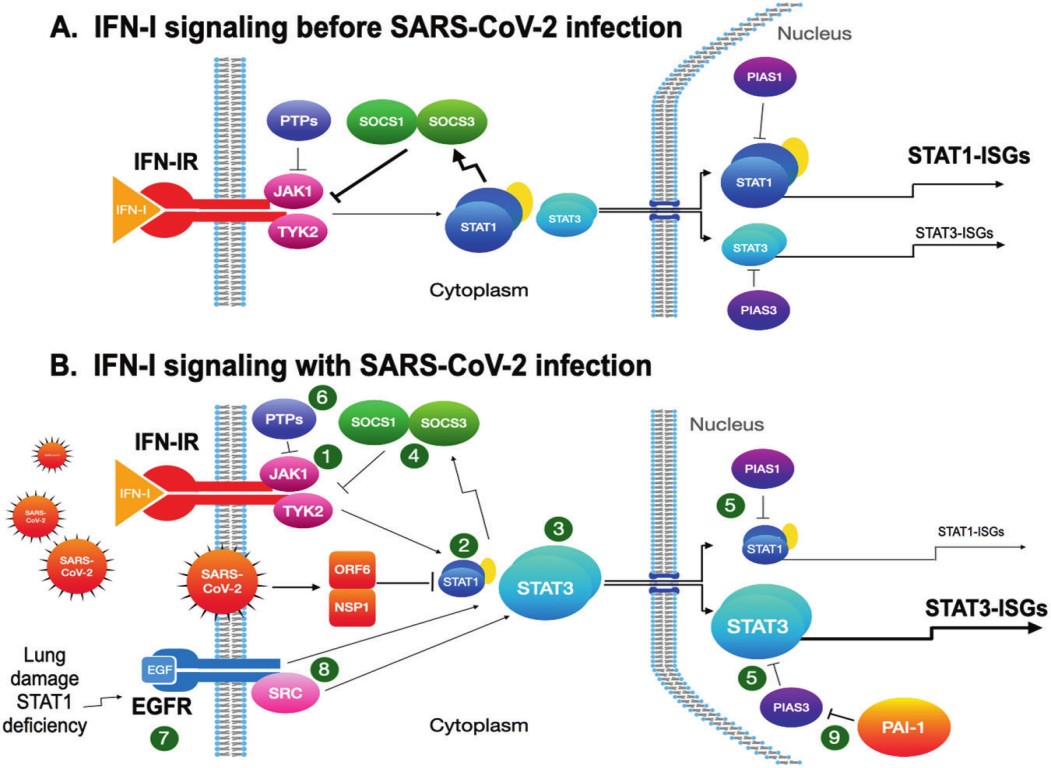
图1:感染前后STAT-1/3信号通路的活化状态
同时,冠状病毒通过ACE-2进入宿主细胞,通过一系列信号通路,最终导致IL-6和TNF-α的表达增加。IL-6和TNFα的表达增加诱导了PAI-1表达的增加,导致严重炎性反应和静脉血栓形成,是重症患者预后差的独立预测因子[2]。在第十版中,已经将IL-6和D-二聚体的检测推荐作为重症患者的风险因子。
EGFR,即表皮生长因子受体(Epidermal growth factor receptor, EGFR),1975年被首次在靶细胞上鉴定出[3]。EGFR属于酪氨酸激酶受体的ErbB家族,包括4种成员: EGFR(HER1、ErbB1)、HER2(ErbB2)、HER3(ErbB3)和HER4(ErbB4)。所有 EGFR成员都有一个细胞外配体结合区、一个疏水跨膜结构域和一个具有蛋白酪氨酸激酶活性的细胞内结构域。,能其他3种ErbB受体形成同源二聚体或异源二聚体,并激活固有激酶的活性,导致细胞质内尾部的特定酪氨酸残基磷酸化,通过多种下游信号通路调控细胞的多种生理过程[4]。
在肿瘤中:EGFR可促进增殖、炎症、血管生成、纤维化、上皮间质转化和转移作用。在新冠病毒感染中:EGFR会促进炎症和纤维化。一般来说,机体对入侵病原体诱导的STAT3激活可在2小时内被SOCS-3(细胞因子传导抑制因子-3)终止。而在EGFR激活状态下,STAT3暴露于IL-6或致癌物下4小时后可再次被磷酸化激活,且再激活后持续时间长达数小时。新合成的IL-6驱动IL-6受体与gp130和EGFR关联,从而导致这种再激活是EGFR依赖性的且不受 SOCS-3 的抑制。STAT3 的二次激活导致IL-6诱导蛋白的持续表达,从而源源不断的产生炎症产物[1]。新冠病毒还可以促进肺上皮细胞EGFR表达的增加,触发炎症反应,诱导PAI-1表达增加,通过凝血途径引起血管内血栓,引起肺纤维化。因此,阻断EGFR在理论上可以成为新冠重症患者治疗的一个策略[5]:即通过抑制EGFR,阻断其与IL-6之间的联系,降低炎症反应即静脉血栓形成,从而降低新冠重症病死率。
尼妥珠单抗,是中国-古巴合资的百泰生物药业生产的一种靶向EGFR的人源化单抗,2008年以我国第一个人源化单抗的身份亮相。十余年来,一直“奋战”在抗肿瘤领域。基于以上的理论基础,古巴开展了一系列临床研究来验证这一策略的有效性。
古巴专家开展了一项单臂、多中心I/II期研究(临床试验注册号: RPCEC00000369 (RPCEC rpcec.sld.cu),评价尼妥珠单抗在确诊SARS-CoV-2感染患者中的初步安全性和疗效。入组人群为重度或中度新冠感染者。中度的标准为:临床评估或影像检查期间显示下呼吸道疾病证据,并且在海平面室内空气环境下SpO2≥94%的受试者;重度的标准为:在海平面室内空气环境下血氧饱和度(SpO2)<94%、氧合指数<300 mmHg、呼吸频率为>30次/分钟或肺部浸润>50%。受试者采用的治疗方案为标准治疗(如糖皮质激素,抗凝,氧疗等)联合尼妥珠单抗。尼妥珠单抗用药方案为:首剂200mg,如果患者仍有实验室或放射学炎症体征,可以每隔72小时给与后续第二或第三剂尼妥珠单抗(100 mg)。主要评价指标为14天出院率。次要指标包括:接受尼妥珠单抗治疗后需要机械通气的患者比例、住院时长、不同时间的炎性指标参数,如CRP、铁蛋白、LDH和IL-6。首次入组的3例患者的病例系列报告发表于2021年11月的Immunotherapy[6]。3例患者的胸部CT影像变化见图2.
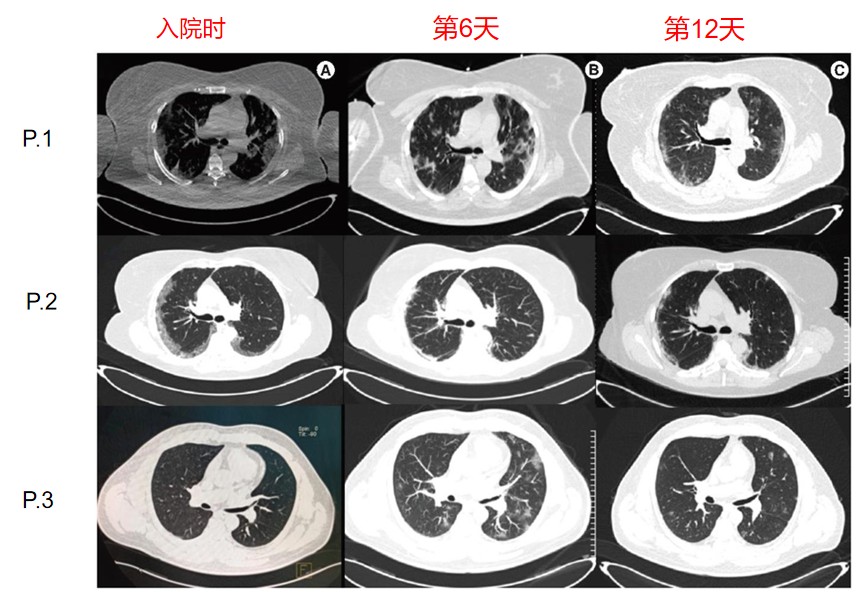
图2: 3例患者胸部CT治疗前后的对比。A)在患者1和2中,入院时观察到双侧炎性实变,主要位于外周。患者3入院时无CT扫描病变。(B)入院第6天,患者1和2显示肺部炎性病变改善,外周部位的放射密度和支气管路径更低。在第6天,患者3显示片状双侧毛玻璃样阴影。(C)入院第12天,3例患者的肺部炎性病变进一步消退,无纤维化体征。
在此基础上,继续纳入受试者至41例,分析报告发表于2022年3月的Immunotherapy[5](IF:4.03)。研究结果显示:41名患者含重度31名,中度10名;中位年龄 62 岁;多数有基础疾病:伴1种基础病的34人,伴2种及以上基础病的20人;7例(17.07%)接受了1次、29例(70.7%)接受了2次、5例(12.19%)接受了3次尼妥珠单抗治疗。8例患者(19.5%)需要有创机械通气。接受尼妥珠治疗后至有创机械通气时间平均3.6天。34例患者(82.92%)接受首剂尼妥珠单抗后14天出院。其中,重度患者80.64%(25/31),中度患者90%(9/10)。在ICU 中位时间为 9 天。治疗第 7 天,76.2%重症患者氧合指数有统计学意义的改善;出院时,CT显示双肺受累区域显著减少。随访均未出现纤维化;测定 28 名患者(21名重度和7名中度)血清 IL- 6 浓 度,治疗前后IL- 6 中位浓度从 46 .5pg/ml 下降到14.51pg/ml。不良反应方面,共2例患者出现了4例次的不良反应,且均为1-2级,无3级以上不良反应。显示尼妥珠单抗安全性良好,可以减少炎症反应,防止中重度肺炎患者的纤维化。
在这一研究基础上,古巴专家继续开展了一项真实世界的研究[7]。数据采集自古巴卫生部2021年7月-12月间入院治疗的新冠感染者资料,纳入标准同上述单臂研究,采用倾向性评分匹配,以年龄、性别、基础病、居住省份为匹配因素按照1:1匹配,共匹配出试验组和对照组各1009例。两组基线水平相当,分析发现:14天出院率:尼妥珠组vs标准治疗组:72% vs 42%,对照组具有更高的死亡风险(RR:2.08,95%CI:1.79-2.38, P=0.000);尼妥珠单抗对死亡的归因分数为0.52(95% CI: 0.44; 0.58),死亡风险降低48%;重症或危重症人群归因分数为0.26(95% CI: 0.22%; 0.29),说明尼妥珠单抗可以避免26%的重症或危重症发生率。亚组分析发现:无论年龄、性别、基础疾病,对照组死亡风险均高于尼妥珠组。其中、90岁以上人群和伴有COPD人群差别最大,对照组死亡风险分别为尼妥珠单抗组的11倍和9倍。该研究结果发表于2022年7月Front Public Health (IF:6.46)。
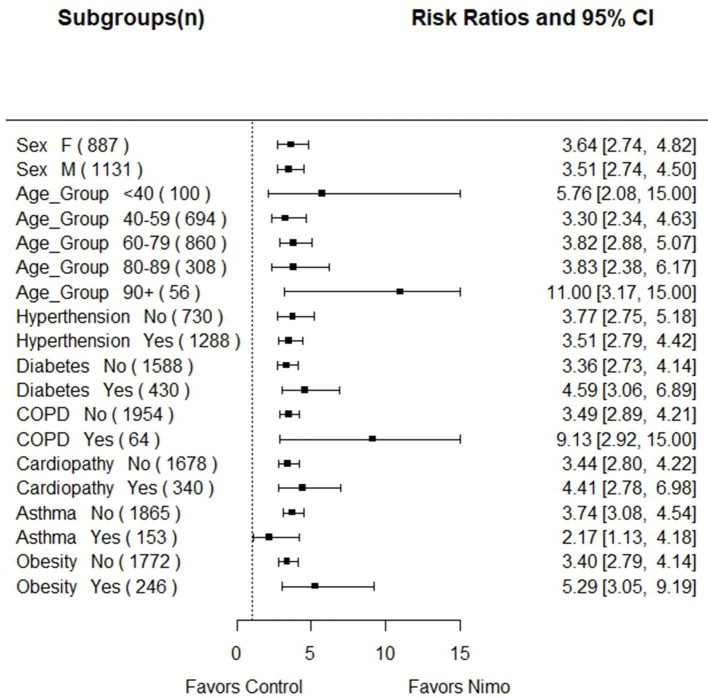
图3:亚组分析的森林图。无论年龄、性别、基础疾病,对照组死亡风险均高于尼妥珠组。其中、90岁以上人群和伴有COPD人群差别最大,对照组死亡风险分别为尼妥珠单抗组的11倍和9倍
这两项研究初步揭示了尼妥珠单抗作为EGFR抑制剂,在联合标准治疗基础上,可减少重症新冠患者死亡率。这有可能会成为目前新冠感染重症患者治疗的一股“生力军”,带来全新的治疗策略:抑制EGFR,下调STAT-3激活,减少炎症反应及静脉血栓形成,从而降低死亡率。目前,百泰生物药业公司已经着手准备开展相关随机对照研究,期待能给当前的新冠治疗带来新的选择。

